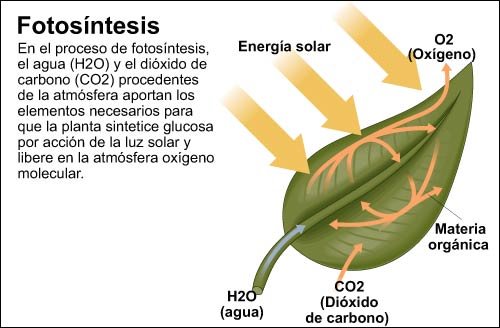
Ecuación química.- Es la representación escrita, abreviada y precisa de una reacción química


Agente Oxidante.- Es todo átomo, ion o molécula que capta electrones; es decir, se reduce, disminuyendo su estado de oxidación
Agente Reductor.- Es todo átomo, ion o molécula que cede electrones; es decir, se oxida, aumenta su estado de oxidación
Numero de Oxidación.- Llamado también número de valencia o estado de oxidación, es el numero de electrones que un átomo o un ion capta, cede o comparte con otro para formar un compuesto.
La formulación y la nomenclatura, además de la igualación de ecuaciones Rédox, establece que es muy necesario conocer es estado de oxidación de una especie química
Para ello es fundamental conocer que:
a) El numero de oxidación de cualquier elemento libre es cero
b) El numero de oxidación de cualquier ion atómico es igual a su carga
c) El numero de oxidación del hidrógeno en los hidruros no iónicos es 1+. Pero en los hidruros metálicos iónicos es 1-
d) El numero de oxidación del oxigeno es 2- en casi todos los compuestos. En los peróxidos es de 1- y en los superoxidos el numero de oxidación es 1/2-
e) La suma algebraica de los números de oxidación de todos los átomos de una formula de un compuesto neutro debe ser cero
f) La suma algebraica de los numero de oxidación de los átomos de un ion debe ser a su carga del ion
Escala Redox.- Es una serie de números positivos y negativos, separados por el cero y bordeados por dos flechas cuyas puntas indican en sentido de la oxidación y reducción
En una siguiente oportunidad daremos a conocer los métodos de igualación de ecuaciones